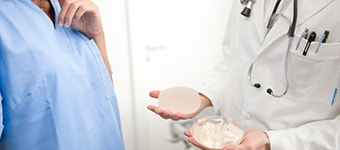
Особенностью физического строения имплантата является максимальное соответствие основным свойствам человеческой ткани. В связи с этим, имплантаты широко применяются в эстетической и реконструктивной хирургии. Каждый тип продукта представлен в различных размерах и формах (См. текущий каталог продукции).
Также настоящие инструкции по применению предназначены для следующих типов имплантатов: постоянных имплантатов молочной железы, пекторальных, имплантатов голени, ягодичных, тестикулярных, временных имплантатов (экспандеров).
Виды имплантатов, предлагаемые компанией POLYTECH, отличаются типом наполнителя и структурой оболочки:
- Временные имплантаты (экспандеры) содержат клапан и поставляются пустыми с возможностью интра- и послеоперационного постепенного заполнения. Они могут иметь гладкую или текстурированную поверхность.
- Имплантаты молочной железы серий Modular System и Sublime Line®, а также пекторальные, ягодичные, имплантаты голени и тестикулярные имплантаты имеют одну камеру, заполняемую одним типом геля. Они могут иметь гладкую или текстурированную поверхность, а также покрытие из микрополиуретановой пены Microthane®.
- В имплантатах молочной железы Diagon\Gel®, включающих серию имплантатов 4Two, существует одна камера, заполняемая двумя типами геля. Они могут иметь текстурированную поверхность, а также покрытие из микрополиуретановой пены Microthane®.
- Также имеются имплантаты, заполненные мягким силиконовым эластомером (тестикулярные имплантаты).
Все используемые для этого типы геля являются высококогезивными, однако их плотность может варьироваться в зависимости от типа имплантата.
Все имплантаты имеют многослойную силиконовую оболочку. Поверхность оболочки представлена в нескольких типах:
- Гладкая: POLYsmoooth™ (REF 10xxx, 5xxxx)
- Текстурированная: MESMO® (15xxx), POLYtxt® (REF 2xxxx, 4xxxx)
- Покрытие из микрополиуретановой пены: Microthane® (REF 3xxxx)
Дополнительная информация об оболочке и поверхности изложена в главе «Информация о материалах».
Дизайн, как и производство, доставка и сервисное обслуживание соответствуют требованиям контроля качества производства согласно директиве ISO 13485. Продукция имеет Европейский сертификат соответствия, в связи с чем полностью соответствует требованиям Директивы ЕС «О Медицинских Изделиях» (MDD) и другим государственным нормативам.
Все используемые материалы тестированы на биосовместимость и соответствуют стандартам качества для медицинских изделий. Также все изделия проходят тестирование механических свойств материала на: растяжение, силу разрыва и усталостное разрушение.
ИНФОРМАЦИЯ О МАТЕРИАЛАХ
Эластичные, плотные имплантаты состоят из полимеризированного полидиметилсилоксана. Поверхность может быть гладкой или текстурированной.
Оболочка имплантатов
Имплантаты POLYTECH имеют химически и механически резистентную мягкую оболочку, из мягкого силиконового эластомера, которая состоит из нескольких слоев полидиметилсилоксана. Оболочка имплантатов, заполненных силиконовым гелем дополнительно имеет специальный барьерный слой. Поверхность имплантатов может быть гладкой (POLYsmoooth™), текстурированной (POLYtxt®, MESMO®) или покрытой микрополиуретановой пеной – Microthane®.
Применение имплантатов с покрытием Microthane® (медицинская микрополиуретановая пена компании POLYTECH) снижает до минимума риск образования капсулярной контрактуры. Использование текстурированных силиконовых имплантатов также ведет к снижению риска развития капсулярной контрактуры за счет оригинальной поверхностной структуры и особой ориентации и длине волокон в тканях капсулы. Имплантаты с гладкой поверхностью также успешно используются с 1960-х годов.
Microthane® (медицинская микрополиуретановая пена компании POLYTECH) связана с оболочкой из эластомера посредством вулканизации. Толщина стенок оболочки зависит от типа имплантата, его поверхности и размера. Приблизительные показатели составляют: у имплантатов с поверхностью Microthane® около 1,25–2,4 мм, у текстурированных имплантатов POLYtxt® 0,45–1,2 мм и MESMO® 0,35–1,0 мм, y гладких POLYsmoooth™ 0,3–0,9 мм. Средний показатель шероховатости поверхности текстурированных имплантатов составляет приблизительно 250 мкм для POLYtxt® и 150 мкм для MESMO®; для имплантатов с микрополиуретановой поверхностью Microthane® приблизительно 1500 мкм.
Материал наполнителя
Имплантаты производятся из плотного силикона, либо заполнены определенным количеством чистого и высоко эластичного силиконового геля, либо могут быть заполнены физиологическим раствором. Наполнители из силиконового геля состоят из полидиметилсилоксана. Этот силиконовый гель обладает так называемым «эффектом памяти», так как способен возвращаться к своей первоначально заданной форме после умеренной компрессии. Для заполнения экспандера рекомендуется использовать стерильный, апирогенный 0,9% раствор хлорида натрия (физиологический).
Выделение веществ
Компания Polytech определила общее содержание силоксанов D4 и D5 теоретически выделяемых при не физиологических условиях, т.е примерно, 1 к 25 000 000, что на несколько порядков меньше величины безопасного уровня для пациентов в соответствии с независимыми актуальными токсикологическими заключениями. По аналогии с заявлением Управления по контролю за продуктами питания и лекарственными средствами США, используемый платиновый катализатор не представляет токсикологической опасности для пациентов.
Дополнительные принадлежности
- Для текстурированных и покрытых микрополиуретаном имплантатов: один полиэтиленовый, открытый на концах, рукав.
- Для кожных экспандеров с выносным клапаном: один большой инъекционный порт с удлиненной силиконовой трубкой с коннектором.
- Для кожных экспандеров со встроенным магнитным клапаном: один магнитный искатель.
ПОКАЗАНИЯ И ВОЗМОЖНЫЕ ПРОТИВОПОКАЗАНИЯ
Имплантаты молочной железы / дополнительные имплантаты
Показания:
- увеличительная пластика (например, при аплазии, гипоплазии) и контурная коррекция (например, при асимметрии, птозе, атрофии);
- реконструкция (например, после мастэктомии);
- замена имплантатов;
- комбинированные деформации грудной клетки и молочной железы (например, синдром Поланда, впалая или килевидная грудная клетка);
- протезирование с использованием дополнительных имплантатов для устранения дефектов;
- поддержка сосково – ареолярного комплекса (для субареолярных имплантатов).
Возможные противопоказания:
В дополнение к общим противопоказаниям для проведения инвазивных вмешательств, клинические противопоказания могут включать:
- психологическую нестабильность пациента;
- повторные неудачные попытки контурной коррекции;
- персистирующая инфекция или системное заболевание;
- аллергии или неординарный иммунный ответ на установку имплантата;
- наличие абсцессов, цист или опухолей в области установки имплантатов, особенно рак и отдаленные метастазы (персистирующий и интермиттирующий рак молочной железы), системные заболевания соединительной ткани;
- тяжелые повреждения облучением в предполагаемой области установки имплантата;
- послеожоговые рубцы в предполагаемой области установки имплантата;
- несостоятельность тканевого покрытия в предполагаемой области установки имплантата (например, предшествующая редукция) или нарушенная васкуляризация;
- нарушения процессов заживления ран;
- наличие травм в области ребер (касается только имплантатов молочных желез);
- беременность и кормление грудью (касается только имплантатов в области молочных желез);
- воспаление в зоне предполагаемой имплантации;
- подавленная иммунная система.
РЕКОМЕНДАЦИЯ: Использование имплантатов молочных желез без наличия медицинских показаний должно распространяться только на пациентов, достигших совершеннолетия в соответствии с национальным законодательством государства.
Тестикулярные имплантаты
Показания:
- Реконструкция после орхоэктомии;
- Врожденные дефекты;
- Асимметрия;
- Реконструкция, например, после травмы;
- Замена имплантата.
Возможные противопоказания:
- См. выше – Для имплантатов молочной железы и дополнительных имплантатов.
Имплантаты голени
Показания:
- увеличение;
- контурная коррекция ног, например, после перенесенного полиомиелита, в случае врожденных дефектов;
- реконструкция после травмы;
- замена имплантата.
Возможные противопоказания:
- См. выше – Для имплантатов молочной железы и дополнительных имплантатов.
Ягодичные имплантаты
Показания:
- увеличение;
- контурная коррекция;
- реконструкция после травмы;
- замена имплантата.
Возможные противопоказания:
- См. выше – Для имплантатов молочной железы и дополнительных имплантатов.
Пекторальные имплантаты
Показания:
- контурная пластика и контурная коррекция;
- устранение дефектов (например, после травмы);
- комбинированные деформации грудной клетки и молочной железы (например, синдром Поланда, впалая или килевидная грудная клетка).
Возможные противопоказания:
- См. выше – Для имплантатов молочной железы и дополнительных имплантатов.
Кожные экспандеры
Показания:
- Временное растяжение ткани и кожи (например, для реконструкции после ампутации молочной железы, после ожогов, потери ткани вследствие травмы) и коррекция дефектов (например, при синдроме Поланда). Мы рекомендуем заменять на постоянный имплантат после 6 месяцев периода экспансии.
Возможные противопоказания:
- См. выше – Для имплантатов молочной железы и дополнительных имплантатов;
- наличие кардиостимулятора в случае использования кожного экспандера со встроенным магнитным клапаном;
- магнитно-резонансная томография, запланированная на период нахождения экспандера в организме.
УПАКОВКА И ДОСТАВКА
Имплантаты поставляются в двойной упаковке, стерильные и поштучно упакованные. Внутренняя упаковка не должна вскрываться или быть поврежденной непосредственно до момента имплантации.
Упаковка каждого стерильного продукта имеет собственную маркировку, указывающую производителя, объем или размер соответственно, каталожный номер и номер серии. Эта маркировка должна быть непосредственно прикреплена в карточку пациента и паспорт имплантата.
Значения символов следующие:
![]() : каталожный номер
: каталожный номер
![]() : номер серии
: номер серии
![]() : срок годности до (год-месяц)
: срок годности до (год-месяц)
![]() : стерилизация паром или сухожаром
: стерилизация паром или сухожаром
![]() : использование только однократно
: использование только однократно
![]() : смотрите инструкции по использованию
: смотрите инструкции по использованию
![]() : 70% максимальная влажность хранения
: 70% максимальная влажность хранения
![]() : 35°C максимальная температура хранения
: 35°C максимальная температура хранения
СТЕРИЛИЗАЦИЯ, СРОК ГОДНОСТИ, ХРАНЕНИЕ
ВНИМАНИЕ: Имплантаты поставляются в стерильной двойной упаковке. В операционной стерильность продукта гарантируется до момента, пока внутренняя стерильная упаковка имплантата не была вскрыта или повреждена. В операционной всегда должен быть еще один такой же имплантат на случай необходимой замены в процессе хирургической процедуры. Для продукции с поврежденной упаковкой стерильность не гарантируется. Если упаковка повреждена, мы не рекомендуем дальнейшее использование такого имплантата. В случае сомнений, пожалуйста, обратитесь в компанию POLYTECH Health & Aesthetics или к своему территориальному дистрибьютору.
Продукция проходит сухожаровую стерилизацию.
Стерильность при неповрежденной упаковке
гарантируется на протяжении 5 лет от момента
стерилизации. Максимальный срок хранения указан на
маркировке (![]() YYYY-ММ).
YYYY-ММ).
Для продукции с поврежденной упаковкой стерильность не гарантируется. В операционной стерильность продукта гарантируется до тех пор, пока внутренняя упаковка не будет открыта или повреждена Имплантаты должны храниться при комнатной температуре в защищенном от влаги месте; при температуре не выше 35°С и относительной влажности не выше 70%. Так как упаковка проницаема для газов, продукция не должна подвергаться воздействию пара или газов. Имплантаты хранятся в горизонтальном положении, так как это позволяет лучше идентифицировать маркировку.
Имплантаты производятся исключительно для однократного использования. Ни при каких обстоятельствах продукция не может быть использована или стерилизована повторно по следующим причинам:
- Так как невозможно продезинфицировать имплантаты без побочных эффектов, отражающихся на качестве оболочки.
- Продукция не может стерилизоваться обычным способом из-за ее вакуумной чувствительности.
- Во время установки или удаления имплантата его целостность, и оболочка в особенности, подвергается максимальной механической компрессии, которая не может быть полностью рассчитана пользователем.
- Международные стандарты предусматривают определенный уровень механической безопасности новых имплантатов, который не может быть гарантирован после установки или удаления имплантатов, так как они подвергались механическому воздействию. Поэтому при повторном использовании требуемая безопасность не гарантируется.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Как правило, каждый пациент или его представитель перед хирургическим вмешательством должен быть информирован врачом о возможных послеоперационных осложнениях, а также непосредственно связанных с установкой имплантатов.
Таким образом, пациенты должны быть проинформированы своим ответственным хирургом о существовании крайне низкого риска развития анапластической крупноклеточной лимфомы. В случае развития серомы или при таких симптомах как отек и боль в области имплантата, возникающие спустя год после операции, пациентам следует обратиться за консультацией к своему лечащему врачу.
Пациенты должны иметь реальные представления о возможных косметических результатах. Пациенты должны быть информированы о том, что имплантаты не имеют безграничных сроков существования, и что со временем их возможно придется заменить. Экспандеры рекомендуются только для временной имплантации с максимальным периодом имплантации 6 месяцев.
Пациентам необходимо рекомендовать регулярно посещать врача-специалиста (каждые 6 или 12 мес.) для контроля состояния имплантата и окружающих тканей. Пациент должен быть предупрежден, что чрезмерное растяжение, резкие движения и травматизация окружающих тканей могут привести к разрыву имплантата или к дефляции экспандера под кожей, что ведет к преждевременной повторной операции и удалению имплантата или экспандера.
Рекомендуется научить пациентов отличать имплантат (и порт, в случае использования экспандеров с вынесенным портом) от собственных тканей и проводить самостоятельный осмотр с целью выявления опухолей. Пожалуйста, предупредите пациентов, что встроенные магнитные клапаны имплантатов и экспандеров могут явиться причиной возможного сбоя бытовых электронных систем, экранов компьютеров и часов.
Паспорт имплантата / экспандера
Паспорт имплантата или экспандера, прилагаемый к каждому продукту «POLYTECH Health & Aesthetics GmbH», заполняется врачом и обеспечивает пациенту в случае необходимости доступ к информации о дате имплантации и виде имплантата.
Диагностический скрининг
Силиконовые имплантаты могут влиять на качество визуализации тканей при проведении различных исследований, и как следствие, быть причиной ложных результатов. Поэтому необходимо, чтобы пациенты информировали медицинский персонал о существующем имплантате или экспандере.
Учитывая возможное взаимодействие магнитных волн, пациенты, имеющие экспандеры со встроенными клапанами, не должны подвергаться магнитно- резонансному исследованию (МРТ). Нельзя исключить полностью возможность влияния такого взаимодействия на здоровье пациента и результаты исследования.
ВНИМАНИЕ: Всем пациентам, у которых установлены экспандеры со встроенным магнитным клапаном и постоянным магнитом, необходимо посоветовать, что в случае необходимости проведения магнитно-резонансного обследования, обязательно необходимо проинформировать врача о наличии у них экспандера с магнитным клапаном.
Для получения более точного результата маммографии, необходимо принимать во внимание, что имплантаты снижают проницаемость рентгеновских лучей. В связи с этим рекомендуются использование техники Эклунда. Ультразвуковое (УЗИ) или магнитно-резонансное (МРТ) исследование может быть альтернативным методам исследования, дающим более точные результаты.
ВОЗМОЖНЫЕ ОСЛОЖНЕНИЯ
Возможные осложнения могут быть связаны с индивидуальным анамнезом, медицинскими препаратами, техникой проведения операции или ведением послеоперационного периода. При установке имплантатов существуют интра - и постоперационные риски возможного развития таких осложнений, как:
- Некроз кожи, пролежень и выпадение может развиться вследствие чрезмерного натяжения покрывающей имплантат кожи (например, при несоответствии большого размера имплантата величине подготовленного для него кармана или слишком быстром растяжении тканей экспандерами); вследствие нарушенной или сниженной васкуляризации кожи (например, в случае травматизации кожного лоскута во время хирургического вмешательства). Лечение стероидами может также приводить к развитию некроза. Курильщики имеют более высокий риск возникновения нарушений кровообращения в покрывающих имплантат слоях кожи. При подобных осложнениях может возникнуть необходимость ревизии имплантата.
- Гематома может повышать риск присоединения инфекции и развития капсулярного фиброза. В связи с этим гематомы должны быть удалены немедленно. Скопление большого количества жидкости после операции или гематома, в случае отсутствия лечения, могут привести к вытеснению или смещению имплантатов. Нерассосавшаяся гематома может потребовать проведение немедленной эксплантации. Тщательный гемостаз во время операции остается основным методом профилактики.
- Серома. В результате травматизации или избыточного движения в послеоперационном периоде могут возникать отеки и боль. Возможным лечением в данном случае является: иммобилизация, компрессия, дренаж и, если необходимо, удаление имплантата.
- Чрезмерный отек может быть вызван накоплением серозной жидкости (см. серома).
- Смещение или длительная боль может быть следствием неправильно подобранного размера или неправильного размещения имплантата. Если эндопротез слишком велик, причиной этих симптомов могут быть капсулярная контрактура и воспалительная реакция, связанная с чрезмерной подвижностью имплантата. В случае операции на молочной железе боль может возникать как в области хирургического вмешательства, так и в грудной клетке, руке, плече.
- Складки (в литературных источниках, обозначаемые как «морщинистость») пальпируемые края имплантата или искривление имплантата может быть связано с несоответствием между имплантатом и размером подготовленного для него кармана или недостаточным тканевым покрытием.
- Инфекции. Присоединение инфекций вследствие постановки имплантатов молочных желез наблюдается крайне редко (0,114%, Brand, 1993). Развитие инфекций неясной этиологии после имплантации требует немедленного лечения. Может понадобиться использование антибиотиков, дренажа или эксплантация. Должен быть произведен посев раневого содержимого. Наиболее частыми возбудителями являются: золотистый стафилококк, эпидермальный стафилококк или стрептококки. Не все инфекции поддаются лечению без удаления имплантата. При постановке эндопротезов молочных желез развитие синдрома токсического шока было отмечено в единичных случаях.
- Покраснение кожи, в литературе описываемое как «сыпь», может наблюдаться с различной частотой, в зависимости от структуры поверхности (приблизительно в 1-5% случаев при использовании имплантатов с покрытием из микрополиуретановой пены Microthane®). Это покраснение кожи не должно приниматься за инфекцию. Оно отличается от инфекции наличием зуда и отсутствием системных симптомов инфекции. Как правило, появляется на 7-10 день после имплантации и удерживается на протяжении 2-3 недель. В случаях, когда лечение абсолютно необходимо, в литературе рекомендуется использование стероидов.
- Капсулярная контрактура / фиброз: Образование соединительно-тканной капсулы вокруг имплантата - это нормальная реакция организма на чужеродное тело. В результате образования капсулярной контрактуры может измениться форма и расположение имплантата.Клинически значимая контрактура капсулы ( III и IV степени по классификации Бейкера) может вызвать боль и привести к эстетическим изменениям внешнего вида. Может быть необходимо удаление имплантата. Закрытая капсулотомия не рекомендуется в связи с возможностью повреждения имплантата. Если нельзя избежать такой капсулотомии, то впоследствии необходимо провести диагностические исследования для исключения возможных повреждений имплантата.
- Десенсибилизация или гиперсенсибилизация может наблюдаться временно или постоянно (полная или частичная, например, в области молочной железы или мошонки). При пери - или трансареолярной установке имплантатов молочной железы могут наблюдаться изменения чувствительности. Кратковременные нарушения чувствительности наблюдались также при установке лицевых имплантатов.
- Диффузия физиологического раствора: Силиконовые эластомеры проницаемы для газа и пара и, следовательно, для физраствора. Диффузия физраствора через оболочку экспандера может сопровождаться потерей жидкости и уменьшением объема.
- Разрыв имплантата или истечение его содержимого является абсолютным показанием для эксплантации. По нашему мнению, наиболее частыми причинами разрыва являются повреждение имплантата (во время операции, например, при слишком коротком разрезе, повреждении хирургическим инструментарием, или после операции, например, при наполнении экспандера, в случае пункций, биопсий, закрытой капсулотомии и т.д.), а также травма или усталость материала являются, по нашему мнению, наиболее частыми причинами этого осложнения. После разрыва имплантата, заполненного гелем, консистенция силиконового геля препятствует его распространению. Однако, нельзя гарантировать, что гель в данном случае полностью сохранит форму. В случае разрыва имплантат должен быть заменен.
- Дефляция экспандера: если рекомендованный 6-ти месячный период экспансии прошел, на оболочке экспандера могут появляться складки, как возможный побочный эффект экспансии, что ослабляет оболочку и ведет к дефляции экспандера.
- Избыточное заполнение экспандеров может привести к ишемии и последующим осложнениям (например, некрозу, выпячиванию). Наполнение экспандеров должно соответствовать индивидуальным условиям.
- Просачивание силикона: возможность проникновения низкомолекулярных силиконовых компонентов не может быть полностью исключена. В норме минимальноеколичество геля остается внутри капсулы вокруг имплантата. Гранулема неизвестного происхождения является показанием для биопсии или эксплантации.
- Риск развития рака: эпидемиологические исследования показали, что частота развития рака у женщин, имеющих имплантаты, не превышает таковую в контрольной группе. Биодеградация микрополиуретановой пены может привести при определенных условиях к выделению 2,4-толуолдиамина. Однако, регистрируемые концентрации 2,4-ТДА находятся на очень низком уровне. Возможный дополнительный риск развития рака в связи с использованием микрополиуретана составляет приблизительно 1:1 миллион (Управление по контролю за качеством пищевых продуктов и лекарственных препаратов, США). Эти цифры убедительно показывают отсутствие значительной дополнительной угрозы, по сравнению со стандартным риском. Для сравнения: средний риск развития рака молочной железы в западных развитых странах составляет 1:9.
- Возможная связь аутоиммунных заболеваний и заболеваний соединительной ткани с имплантатами молочной железы в настоящее время обсуждается. Однако, в настоящее время доказательств наличия подобной связи не существует.
- Возможно возникновение доброкачественной кальцификации вокруг имплантата.
- Возможность грудного вскармливания может пострадать, однако, не в связи с самими имплантатами, а в связи с хирургическим вмешательством на молочной железе.
- Не существует доказательств, что имплантаты молочной железы могут нанести вред здоровью младенца.
- Анапластическая крупноклеточная лимфома (АККЛ): Ряд исследований показал возможную связь между имплантатами молочной железы и развитием АККЛ. На основании данного исследования можно утверждать, что у женщин с имплантатами молочной железы риск развития АККЛ крайне невысок. Пациенты должны быть проинформированы своим ответственным хирургом о существовании низкого риска развития АККЛ и им рекомендуется проконсультироваться с лечащим врачом в случае возникновения серомы или при таких симптомах как отек или боль в области имплантата, возникающие спустя год после операции.
- Отек подмышечных лимфатических узлов.
- Поверхностная рана.
- Асимметрия: молочные железы выглядят неодинаковыми по размеру, форме и/или положению. Возможно, ассиметрию, присутсвующую до операции, будет невозможно полностью скомпенсировать путем использования имплантатов.
- Атрофия ткани молочной железы / деформация стенки грудной клетки: Кожа, покрывающая имплантат, может стать тонкой вследствие натяжения, под которым она находится, и/или грудная клетка может деформироваться вследствие давления, создаваемого имплантатом. Это может привести к повторным операциям.
- Позднее заживление раны: период заживления у разных пациентов различается в зависимости от типа хирургической операции и места разреза. У некоторых пациентов, особенно у курильщиков, возможно значительное запаздывание заживления раны. В этом случае имеется повышенный риск инфекции, выпячивания, выбухания и/или некроза.
- Воспаление или раздражение являются реакциями организма на инфекцию или травму, они проявляются в виде покраснения, отека, боли и/или утраты функции.
- Птоз: расслабление ткани молочной железы под действием силы тяжести, вследствие беременности, массы тела или возраста.
- Неудовлетворительный результат для пациента или врача с точки зрения формы или размера можно минимизировать тщательным планированием хирургической операции, однако исключить его невозможно. Может помочь ревизионная хирургическая операция, однако она связана с новыми рисками.
- Имплантат может быть видимым при использовании текстурированных или крупных имплантатов, а также при субгландулярном размещении или недостаточном покрытии тканями.
ХИРУРГИЧЕСКИЕ ТЕХНИКИ ВЫПОЛНЕНИЯ ОПЕРАЦИЙ
В зависимости от ситуации и результатов предварительного осмотра, выбор хирургической тактики остается на усмотрение врача и находитсяв зоне его ответственности. Пациенты должны быть обследованы заблаговременно до операции. Хирургу необходимо убедиться в том, чтобы ткань в достаточном объеме и без натяжения покроет имплантат и место разреза. Необходимо избегать давления, натяжения и других факторов воздействия, которые могут оказать сопротивление на имплантат и место разреза. Разрез может быть выполнен в складке под молочной железой в подмышечной впадине, над верхней частью ареолы или под нижней частью ареолы. Имплантат может располагаться под молочной железой, под фасцией, полностью или частично под мышцей. Необходимо исключить факторы давления, натяжения или других форм воздействия на имплантат и место разреза.
Предоставляемые изделия предназначены только для имплантации квалифицированными хирургами.
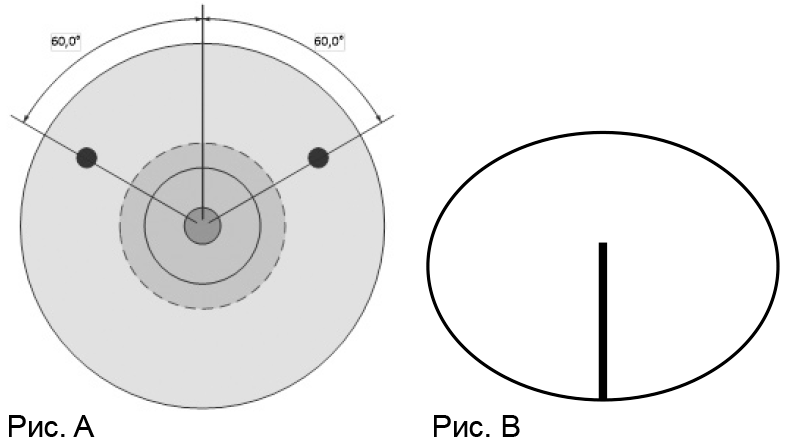
Для обеспечения правильного расположения анатомического имплантата, имплантаты анатомической формы оснащены тактильно- ориентированными признаками: тыльная сторона имплантата имеет ориентационные точки (Рис. А); на фронтальной стороне имплантата ориентационные полосы располагаются по центру от экватора в точке максимального выступа (Рис. B).
Ни в коем случае имплантаты не должны быть видоизменены до или во время проведения операции. Предварительно каждый имплантат следует проверить на возможные повреждения.
Имплантация должна быть проведена с большой осторожностью. Имплантаты могут повредиться при чрезмерном надавливании, при манипуляциях или при помощи хирургических инструментов. В случае повреждения оболочки из эластомера, силикон может просочиться из имплантата. Таким образом, важно удостовериться в том, что во время операции имплантат не был поврежден остроконечными или заостренными предметами (скальпелем или аналогичными инструментами). К тому же необходимо избегать дополнительного растяжения имплантата, так как это может привести к разрыву оболочки.
При имплантации эспандеров, врач должен иметь опыт в их установке во избежание нанесения вреда пациентке или повреждения изделия. Необходимо проверить целостность оболочки до имплантации эспандера путем частичного заполнения стерильным солевым раствором и при умеренном надавливании на оболочку.
Строго запрещается имплантировать поврежденные или видоизмененные изделия. Во время операции рекомендуется иметь запасной имплантат!
Необходимо избегать прямого контакта имплантата с лекарственными препаратами.
Для установки текстурированных или имплантатов, покрытых микрополиуретановой пеной Microthane мы рекомендуем использовать полиэтиленовый «рукав» (см. технику Дольского), который прилагается к имплантату.
Должны соблюдаться следующие основополагающие правила:
- Разрез должен соответствовать размеру и поверхности имплантата.
- Гемостаз должен осуществляться тщательно. Коагулятор может повредить покрытие имплантата.
- Размер имплантата подбирается тщательно. Рекомендуется иметь в наличии имплантаты различных размеров, что позволяет выбрать наиболее подходящий размер. Для определения размера во время операции мы рекомендуем использовать примерочные имплантаты (сайзеры) (см. прайс-лист).
- Размер имплантационного кармана должен соответствовать имплантату. Имплантат должен располагаться ровно, без складок.
- Должно быть обеспечено соответствующее покрытие тканями или, в случае необходимости, предпочтительным может быть подмышечное расположение.
Предотвращение заражения
На поверхность имплантата ни в коем случае не должны попасть тальк, пыль или кожные масла. Ватные волокна, тальк и другие вещества могут притягиваться электростатическими зарядами. Это может провоцировать усиленную реакцию организма на чужеродное тело после имплантации. Необходимо соблюдать особую осторожность для исключения подобных заражений. Весь участвующий персонал должен обрабатывать стерильные перчатки стерильным физиологическим раствором перед прикосновением к имплантату.
Рекомендуемая последовательность действий
- Открыть наружную упаковку в асептических условиях.Удалить наружную стерильную упаковку. Прикрепить маркировку имплантата к карточке пациента.
- Открыть наружную стерильную упаковку. Передать внутреннюю стерильную упаковку медсестре для размещения на стерильном столе для инструментов в стерильных условиях. Ту же процедуру необходимо осуществить с отдельно упакованными дополнительными принадлежностями.
- Открыть внутреннюю стерильную упаковку в стерильных условиях непосредственно перед имплантацией, приготовить стерильный имплантат в соответствии с планируемой методикой хирургического вмешательства и передать имплантат хирургу.
Техника Дольского
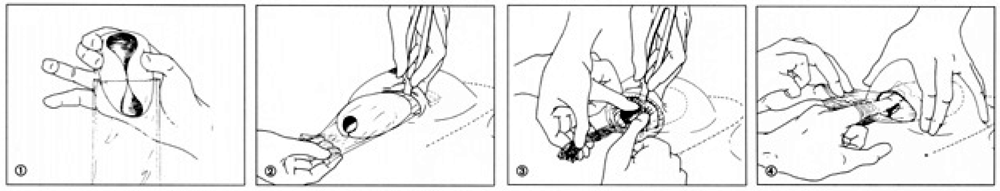
- Обработайте имплантат и «рукав» стерильным солевым раствором.
- Поместите имплантат в «рукав» (1).
- Согните проксимальный участок «рукава» над вершиной имплантата.
- Скрутите дистальный отдел «рукава» до тех пор, пока «рукав» плотно не будет прилегать к имплантату.
- Введите «рукав» с имплантатом проксимальным концом, откройте «рукав» держа за верхушку (2).
- Установите имплантат в необходимой позиции и удерживайте его (3) пока не будет удален «рукав» (4).
Наполнение экспандеров
ПРЕДОСТЕРЕЖЕНИЕ: Все экспандеры используются для временной имплантации! Мы рекомендуем максимальный период имплантации 6 месяцев.
Для наполнения экспандера через инъекционный клапан стерильным апирогенным, физиологическим (0,9%) раствором используется игла 23 G (например, марки Sterican с номерами артикулов 4657667 и 4665635, B.Braun, Melsungen). Также могут использоваться канюли с меньшим диаметром: размер 24, 25 и т.д. Внутри клапана находится барьер для пункции канюлей.
До имплантации, целостность оболочки и функциональность клапана должны проверяться при помощи частичного наполнения имплантата и умеренном давлении на оболочку. Поврежденный и видоизмененный продукт не должен быть имплантирован. Пузырьки воздуха необходимо удалить до имплантации.
Первое или последующее наполнение зависит от индивидуальных анатомических потребностей. Интервалы между последующими заполнениями экспандера устанавливаются по соглашению между врачом и пациентом. Необходимо остерегаться чрезмерного растяжения ткани или экспандера.
Перед окончательным ушиванием раны необходимо убедиться, что экспандер лежит на ткани ровно, без складок.
После операции, при последующих подкачках могут сформироваться новые складки в оболочке экспандера которые, однако, должны учитываться как побочный эффект экспансии. Превышение рекомендованного 6-ти месячного периода имплантации может привести к ослаблению оболочки и дефляции экспандера.
Такой эффект наиболее вероятен, если промежутки между подкачками увеличены. Поэтому экспандер следует заполнять так быстро, как позволяют обстоятельства.
Когда растяжение будет завершено, экспандер должен быть удален.
Экспандеры с вынесенным клапаном
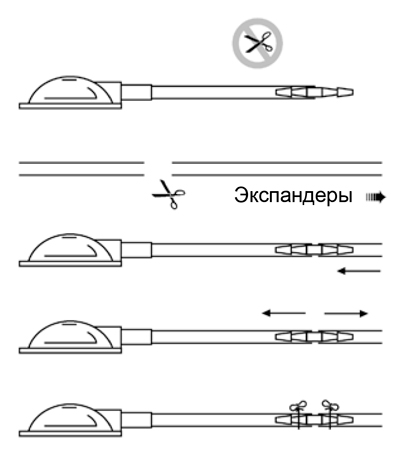
При установке клапана и обработке трубки, пожалуйста, следуйте ниже указанной инструкции.
- Выносной клапан соединен с 5-ти сантиметровым отрезком трубки, который нельзя укорачивать.
- Если необходимо, отрежьте трубку, соединенную с экспандером на необходимом расстоянии.
- Соедините трубку экспандера с коннектором, расположенным на конце 5-ти сантиметровой трубки. Оба конца трубки расположите таким образом, чтобы они доходили как минимум до плеча средней рельефной части коннектора.
- Проверьте правильность положения и прочность удерживания двух трубок в коннекторе.
- Для усиления фиксации мы рекомендуем закреплять оба конца трубки, используя неабсорбирующий шовный материал. Будьте аккуратны, чтобы не перфорировать трубку.
- При размещении выносного клапана необходимо принимать во внимание удобство при движении пациента; трубка и экспандер не должны растягиваться.
Экспандеры со встроенным клапаном и постоянным магнитом
ПРЕДОСТЕРЕЖЕНИЕ: Экспандеры со встроенными магнитными клапанами не должны использоваться у пациентов, имеющих кардиостимуляторы, а также у пациентов, которым в период имплантации необходимо магнитно-резонансное обследование.
Двухкамерные экспандеры состоят из двух отдельно заполняемых камер. Задняя камера с овальным основанием имеет в верхней трети встроенный клапан. Передняя круглая камера, связанная с основной камерой, также имеет встроенный клапан.
Однокамерные экспандеры имеют только один встроенный клапан.
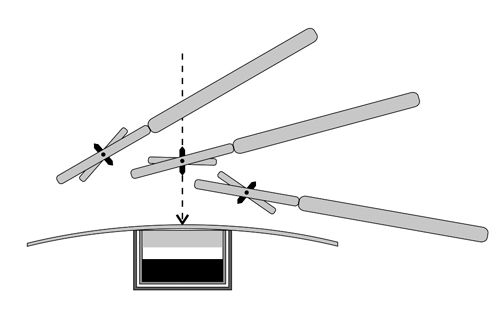
Перед тем как ушить карман, обязательно убедитесь в отсутствии складок оболочки экспандера в области встроенного магнитного порта. Использование постоянных магнитов в клапане обеспечивает легкое определение расположения клапанов после имплантации. Используйте магнитный искатель для определения места расположения клапана. Карданный механизм магнитного искателя позволяет точно определять расположение магнитов в клапане и направление инъекции. С этой целью магнитный искатель водится вверх и вниз слева направо по поверхности кожи в области расположения магнитного клапана, до тех пор, пока магнит не станет перпендикулярно над клапаном. Кончиком магнитной стрелки слегка нажмите на кожу, обозначив, таким образом, место введения.
ПРЕДОСТЕРЕЖЕНИЕ ДЛЯ ТЕСТИКУЛЯРНЫХ ИМПЛАНТАТОВ!
Если имплантат не фиксируется, направляющая тефлоновой иглы может быть удалена перед имплантацией. Направляющая тефлоновой иглы должна быть обязательно удалена перед окончательным ушиванием раны.
ПОСТОПЕРАЦИОННЫЙ ПЕРИОД
Состояние пациента после имплантации должно контролироваться на протяжении определенного промежутка времени с целью оказания своевременной квалифицированной помощи (см. «осложнения»).
Удаление имплантатов
В случае необходимости удаления имплантата, рекомендуется выполнить это тщательно и осторожно. Необходимо применять стандартные методики, которые лучше всего подходят к каждому конкретному случаю. Удаленные имплантаты следует утилизировать и дезинфицировать в соответствии с государственными нормативами. Удаленные имплантаты не представляют опасности для человека или окружающей среды и могут быть утилизированы как стандартные бытовые отходы, если они не инфицированы.
Эксплантация имплантатов, покрытых полиуретановой пеной может привести к отсоединению пены, оставляя ее части интегрированными в тканевой капсуле и в виде остатков на силиконовой оболочке. В целом, такое отсоединение полиуретановой пены не влечет за собой дополнительных рисков, поскольку пена, как и весь имплантат, пригодна для длительной имплантации и может оставаться в теле. Исключением является случай, когда тканевая капсула, в которую интегрировалась пена, напрямую вовлечена в осложнение, например, инфекцию. В этом случае стандартной процедурой является капсулэктомия. Другим исключением является установка нового имплантата с покрытием из полиуретановой пены. Эти импланты всегда следует устанавливать в «девственную» ткань, так как это значительно снижает риск капсулярной контрактуры. При повторном использовании для имплантата того же кармана должна быть выполнена капсулэктомия. Особым случаем является отсоединение полиуретановой пены вследствие ранее перенесенных осложнений, таких как серома. Жидкость серомы скапливается между силиконовой стенкой имплантата и капсулой. Скопление жидкости приводит к разрыву полиуретановой пены, вызывая отсоединение пены от имплантата. Вне зависимости от отсоединения полиуретановой пены, в случае возникновения осложнения, требующего ревизионной операции, решение о дальнейших действиях принимается лечащим хирургом. В целом, следует отметить, что вне зависимости от типа поверхности имплантата, лечащий хирург определяет конкретную методику и принимает решение наличии показаний к капсулэктомии или капсулотомии в случае необходимой или желаемой эксплантации. Эти операции являются стандартными хирургическими процедурами и связаны с общеизвестными потенциальными рисками.
ГАРАНТИИ
Продукция производится и контролируется в соответствии с требованиями Акта «О Медицинских Изделиях». Все отдельные компоненты были тщательно отобраны, и также, как и производство, отвечают требованиям новейших медицинских стандартов и технологий.
Информация, приведенная в данной инструкции по Использованию имплантатов, должна быть принята во внимание. Возможность замены продукции POLYTECH Health & Aesthetics GmbH, рассматривается только в случае точно доказанного производственного дефекта.
Нет никаких гарантий, будь то прямо выраженных или подразумеваемых, в том числе каких-либо гарантий по коммерческому праву, а также каких-либо гарантий в отношении изменений, которые пользователь может внести в продукцию.
Представители и дистрибьюторы не уполномочены изменять приведенные выше предостережения и предосторожности. Ни физическому и ни юридическому лицу не позволяется брать на себя обязательства или ответственность, за исключением производителя.
Возврат продукции
Пожалуйста, не возвращайте продукцию без предварительного письменного уведомления POLYTECH Health & Aesthetics GmbH.
За дальнейшими сведениями обращайтесь к нашим Стандартным Срокам и Условиям Контракта, которые напечатаны в документе доставки и в счете. Бесплатная копия может быть предоставлена по Вашей просьбе.
Наша деятельность основана на стандартах качества Международной Организации по Стандартизации. В своем производстве и управлении качеством мы руководствуемся соблюдением Акта «О Медицинских Изделиях» и нормативам ISO 13485, начиная от выбора сырья, дизайна продукции, производства, стерилизации, хранения, и заканчивая доставкой готового продукта клиентам.