Пресс-релиз
перевод с английского языка
Официальное Заявление POLYTECH Health & Aesthetics GmbH на решение Управления здравоохранения Франции (ANSM)
Сегодня, после решения Национального Агентства по безопасности лекарственных средств и товаров для здоровья (ANSM) о запрете использования нескольких видов текстурированных имплантатов и имплантатов с полиуретановым покрытием на французском рынке, компания POLYTECH Health & Aesthetics GmbH, международный лидер в области эстетики груди, опубликовала официальный ответ. Дибург, Германия, 4 апреля 2019
Компания POLYTECH Health & Aesthetics GmbH, международный лидер в области эстетики груди и единственный немецкий производитель грудных имплантатов, сегодня опубликовала свой официальный ответ на решение Национального Агентства по безопасности лекарственных средств и товаров для здоровья (ANSM) о запрете использования макротекстурированных имплантатов и имплантатов с полиуретановым покрытием на французском рынке.
Решение основано на возможной связи текстурированных грудных имплантатов и развития BIA-ALCL (анапластическая крупноклеточная лимфома, связанная с имплантатом молочной железы). Новая директива указывает, что продвижение гладких имплантатов и тех, которые в соответствии с собственной классификацией ANSM являются микротекстурированными, к которым относятся имплантаты MESMOsensitive® POLYTECH, одобрены для использования во Франции. Компания будет продолжать продавать POLYsmoooth® и MESMOsensitive® во Франции.
POLYTECH официально высказала свои возражения против выводов, сделанных ANSM, несмотря на тот факт, что микротекстурированные и гладкие имплантаты являются неотъемлемыми частями линейки продукции (портфолио) компании. Данное решение ANSM не основано на каких-либо научных доказательствах, статистике хирургов и их пациентов во Франции. В этой связи теперь пациентам будут предложены очень ограниченные варианты, которые не смогут позволить им достичь безопасного и оптимального хирургического результата. Компания полностью согласна с выводами и заявлениями более 22 международных пластических и эстетических европейских сообществ в более чем 20-ти странах.
POLYTECH недавно расширила ассортимент и теперь предлагает B·Lite® - легковесный имплантат с гладкой поверхностью, как уникальную и превосходную альтернативу для хирургов и пациентов. Компания продолжит предлагать свои текстурированные имплантаты и имплантаты с полиуретановым покрытием, которые, согласно многочисленным научно обоснованным клиническим исследованиям, безопасны и позволяют снизить показатели наиболее распространенных осложнений.
«Как ведущий производитель грудных имплантатов, мы обязаны просвещать, как хирургов, так и пациентов, о возможности возникновения BIA-ALCL (анапластическая крупноклеточная лимфома, связанная с имплантатом молочной железы), с анализом доказательств, последних медицинских публикаций и наших накопленных знаний», - заявил Вольфганг Штаймель, генеральный директор POLYTECH, на официальном слушании ANSM.
«Несмотря на то, что это очень редкое осложнение, мы полностью осознаем, что BIA-ALCL очень серьезная проблема. Однако мы считаем, что запрет на имплантаты с текстурированным и полиуретановым покрытием является ложным решением с точки зрения общей безопасности пациента, когда запрет основан только на имеющихся в настоящее время фактах», - добавляет г-н Штаймель.
У POLYTECH также была возможность представить свою позицию через официального представителя этой отрасли - Федеральной Ассоциации Медицинских Технологий, е.V. Германия (BvMed), г-жу Эльке Фогт (Mrs. Elke Vogt).
«По мере того, как мы рассматривали информацию, имеющуюся на сегодняшний день, стало понятно, что нет четких научных доказательств о взаимосвязи между BIA-ALCL и конкретной поверхностью имплантата», продолжает г-н Штаймель. «Согласно данной информации, нельзя исключить возможную связь возникновения BIA-ALCL с любым типом имплантатов, включая гладкие имплантаты». Это подтверждено новейшей информацией FDA (Управление по Контролю за пищевыми продуктами лекарственными препаратами) от 6 февраля 2019 года, в которой зафиксирован ряд случаев возникновения BIA-ALCL только с гладкими имплантатами.
По данным FDA, существует около 660 зарегистрированных случаев возникновения BIA-ALCL. По идее, более высокий процент должен быть с текстурированными имплантатами. Однако, в тридцати процентах этих случаев отсутствует информация о типе оболочки имплантата. Исследования Лок Уилкинсона (Lock Wilkinson) и соавторов часто цитируются предоставляя информацию о пятнадцати случаев возникновения BIA-ALCL с полиуретановыми имплантатами. Однако, все эти случаи произошли с полиуретановыми имплантатами, изготовленными другим производителем, который утратил знак соответствия Европейским Директивам качества в 2015 году. В то время как текущий риск развития BIA-ALCL рассчитывается FDA между 1: 3,000 и 1: 30,000. Риск с имплантатами, реализованными POLYTECH, составляет 3: 1, 100, 000, а риск, связанный с полиуретановыми имплантатами Microthane®, составляет менее 1: 160,000.
Общие данные о BIA-ALCL на сегодняшний день основаны только на зарегистрированных случаях, а не на предполагаемых, контролируемых испытаниях, согласно требованиям доказательной медицины.
«На наш взгляд, запрет на текстурированные имплантаты приведет к значительному увеличению числа повторных операций из-за более высоких показателей капсулярной контрактуры. Даже если надзорный орган здравоохранения Франции не рекомендует и не предлагает удаление запрещенных имплантатов, пациенты могут подумать, что их вынуждают пройти повторную операцию для замены текстурированных имплантатов на гладкие из-за боязни потенциальных последствий, для которых, впрочем, нет научных доказательств». В соответствии с опубликованными данными, риски, связанные с повторной операцией или анестезией, сами по себе, выше, чем риск возникновения BIA-ALCL», - добавил г-н Штаймель.
«Мы полагаем, что просвещение пациентов должно быть прозрачным, не только в отношении возникновения BIA-ALCL, но и всех возможных осложнений. Осведомленность пациентов позволит им сделать осознанный выбор относительно процедуры имплантации и типа имплантата», - заключил г-н Штаймель. «Европейские власти выразили надежду, что осведомленность пациентов и прозрачность информации, касающейся рисков возникновения BIA-ALCL, а так же других возможных осложнений, станет приоритетом, в первую очередь, не только для хирургов, но и для производителей. Мы уже предпринимаем шаги, чтобы предоставить информацию, основанную на фактах, доступной общественности».
Портфолио POLYTECH
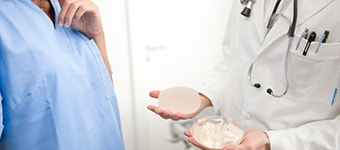
Линейка продукции грудных имплантатов POLYTECH включает в себя широкий спектр форм и размеров, с четырьмя разными поверхностями: гладкие, с двумя разными типами текстур и имплантаты с полиуретановым покрытием (PU), поставляется на рынок с начала 1970-х годов. Полиуретановая пена, которая покрывает имплантат, представляет собой трехмерную матрицу, которая взаимодействует с окружающей тканью механическим и биологическим путями по сравнению с текстурированными имплантатами. Исторически считается, что текстурированные имплантаты были разработаны в 1980-х годах для имитации формы и преимуществ полиуретанового покрытия имплантатов.
Это очень распространенная концептуальная ошибка - принимать имплантаты с полиуретановым покрытием за текстурированные имплантанты. Механизмы, связанные с адгезией тканей и образованием фиброзных капсул, принципиально отличаются от текстурированных имплантатов: такое взаимодействие ткани с полиуретановым волокном, является ключом к низким показателям капсульной контрактуры.
О POLYTECH
Компания имеет мировое присутствие в более чем в 75 странах. POLYTECH Health & Aesthetics GmbH - международный лидер в разработке и производстве силиконовых имплантатов. Основанная в 1986 году в Дибурге, Германия, компания специализируется на грудных имплантатах, используемых как в реконструктивной, так и эстетической пластической хирургии.
POLYTECH - единственный немецкий производитель имплантатов мягких тканей. Все продукты разрабатываются исключительно в штаб-квартире компании в Германии и изготовлены в стерильных условиях. В компании работает более 250 человек.
* Продукты POLYTECH не продаются в США.
Для получения дополнительной информации посетите наш сайт: https://polytechhealth.com/en/
____________________________________________________________________________________
Press release Medical / MedTech
POLYTECH Health & Aesthetics GmbH
Breast Aesthetics Company POLYTECH Releases Official Statement Following the French Health Authority Decision
POLYTECH Health & Aesthetics GmbH, an international leader in Breast Aesthetics, released today its official response following the ANSM decision to ban several textured implants and polyurethane implants from the French market.
Dieburg, Germany, April 4th 2019. POLYTECH Health & Aesthetics, an international leader in breast aesthetics and the only German manufacturer of breast implants, released today its official response following the French Agence Nationale de Sécurité du Médicament (ANSM) recent decision to ban what it considers macro-textured implants and polyurethane-coated implants from the French market.
The decision is based on a possible association between textured breast implants and the development of BIA-ALCL (breast implant-associated anaplastic large cell lymphoma).1 The new directive indicates that moving forward, smooth implants and those implants that according to the ANSM’s own classification are micro-textured - to which POLYTECH´s MESMOsensitive® counts - is approved for use in France.2 The company will continue to sell their POLYsmoooth® and MESMOsensitive® surfaces in France.
POLYTECH has officially expressed its objections to the conclusions of the ANSM despite the fact that microtextured and smooth implants are an integral part of the company’s portfolio. The ANSM decision is not based on any scientific proof and surgeons and their patients in France will now be offered very limited options, that may not allow them to achieve a safe and optimal surgical result. The company does completely agree with the findings and statements of more than 22 international Plastic & Aesthetic European Societies in more than 20 countries.
POLYTECH has recently broadened its product range and now offers the B·Lite® lightweight implant with a smooth surface, as a unique and excellent alternative for surgeons and patients. The company will also continue to offer their textured and PU coated implants, which according to numerous scientifically valid clinical studies are safe, and allow for lower rates of the most common complications.
"As a leading manufacturer of breast implants, it is our obligation to educate both surgeons and patients on the subject of BIA-ALCL, with evidence-based information, recent medical publications and our gathered knowledge," stated Wolfgang Steimel, POLYTECH’s CEO, at the official ANSM hearing. "Even as it is a very rare complication, we take the appearance of BIA-ALCL very seriously. However, we believe that a ban of textured and polyurethane-coated implants is a false decision in terms of the overall patient safety, when it is based on the currently available facts” Mr. Steimel adds.
POLYTECH also had the opportunity to present its position through the official industry representative of the Federal Association of Medical Technology e.V. Germany (BvMed), Mrs. Elke Vogt.
"As we review the information gathered to date, there is no clear scientific evidence of an association between BIA-ALCL and a specific implant surface", Mr. Steimel continues. "According to the available information, it is impossible to rule out any implant type, including smooth implants, from a possible association with the occurrence of BIA-ALCL". This is confirmed by a recent update from the FDA dated February 6, 2019, that recorded a number of BIA-ALCL cases with smooth only implants. 3
According to the FDA, there are approximately 660 recorded cases of BIA-ALCL, with a seemingly higher occurrence in textured implants. However, in thirty percent of the recorded cases there is no information on the type of implant concerned.4 A study by Loch Wilkinson et al. is often quoted as reporting fifteen cases of BIA-ALCL with polyurethane implants.5 However, these cases occurred with polyurethane-implants manufactured by a different manufacturer, that lost its CE mark in 2015. While the current BIA-ALCL risk is calculated by the FDA as between 1:3,000 and 1:30,000 6 the risk with POLYTECH implants is of 3:1,100,000 implants sold, and the specific risk related to Microthane® is less than 1:160,000.
The overall data on BIA-ALCL to date, is based on the reported cases and not on prospective, controlled trials, as required by evidence-based medicine.
“The ban on textured implants will, in our view, lead to a significant increase in the number of reoperations due to higher capsular contracture rates. Even though the French authority does not recommend, nor even suggest the explantation of the banned implants, patients may feel compelled to undergo reoperation and exchange their textured implants with smooth implants for fear of potential consequences - for which there is no scientific proof. The risks implied by a re-operation, or by anaesthesia, are per se higher than the BIA-ALCL risk according to published data.” Mr. Steimel added.
"We believe that patient education should be transparent, not only in regards to BIA-ALCL, but for all possible complications. Patients education will enable them to make informed choices about their procedure and implant type" Mr. Steimel concluded. "The different European authorities expressed their expectation that patient education and transparent information regarding BIA-ALCL and other possible complications, will become a priority primarily for the surgeons, but also for manufacturers. We are already taking steps to make evidence-based information available to the public.”
About the POLYTECH Portfolio
The POLYTECH breast implant portfolio includes a wide variety of shapes and sizes, in four different surfaces: smooth, two different types of textures and implants coated with polyurethane-foam (PU): marketed since the beginning of the 1970‘s, the PU-foam that coats the implant is a three-dimensional matrix that has a different mechanical and biological interaction with the surrounding tissue compared with textured implants. Historically, textured implants were developed in the 1980‘s to mimic the shape and benefits of PU-coated implants. It is a very common conceptual error to consider PU-coated implants as textured implants. The mechanisms related to tissue adhesion and fibrous capsule formation are fundamentally different from textured implants: this tissue interaction with the polyurethane fibres is key to the low rates of capsular contracture.7
About POLYTECH
With a global footprint in over 75 countries, POLYTECH Health & Aesthetics GmbH is an international leader in the development and production of silicone implants. Founded in 1986 in Dieburg, Germany, the company focuses on breast implants, used in both reconstructive and aesthetic plastic surgery. POLYTECH is the only German manufacturer of soft tissue implants. All products are developed exclusively at the company headquarters in Germany, and are manufactured under clean room conditions. The company employs over 250 people. For more information visit https://polytechhealth.com/en/
* POLYTECH products are not sold in the US.